Virothérapie
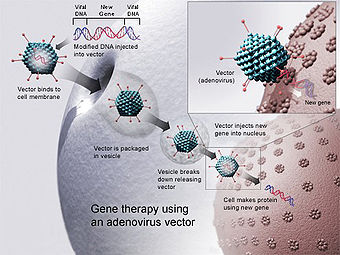
Un nouveau gène est inséré dans un vecteur qui est un adénovirus modifié, lequel est utilisé pour introduire l'ADN modifié dans une cellule humaine. Si le transfert se déroule correctement, le nouveau gène élaborera une protéine fonctionnelle qui pourra alors exprimer son potentiel thérapeutique.
La virothérapie est une stratégie thérapeutique consistant à utiliser un virus (un adénovirus, un virus adéno-associés[1] ou un rétrovirus ou un autre virus après l'avoir reprogrammé par les moyens du génie génétique) pour éliminer des cellules ou tissus d'un organisme ou reprogrammer certaines cellules dysfonctionnelles.
Typologie[modifier | modifier le code]
Deux grandes catégories de virothérapie peuvent être distinguées.
Thérapie génique[modifier | modifier le code]
La thérapie génique est l'exemple le plus médiatisé et connu de virothérapie. Son principe consiste à remplacer ou complémenter un allèle mutant défectif par un allèle fonctionnel (ou à surexprimer une protéine dont l'activité aurait un impact thérapeutique).
Le matériel génétique est introduit par un rétrovirus dans la cellule pour « réparer » la lignée cellulaire ou l'une de ses fonctions vitales ; via un vecteur lentiviral (virus humain modifié et « sécurisé »), il semble également possible de modifier génétiquement des cellules au repos, dont des neurones, ou des cellules hépatiques que les vecteurs rétroviraux d'origine murins n'atteignaient pas[2] ; dans ce cas, le vecteur est à la fois le porteur du transgène thérapeutique et la seringue qui l'injectera dans le génome de la cellule-cible, mais ce virus n'a pas à se reproduire lui-même en infectant la cellule (c'est un virus recombinant également transformé pour être « déficient pour la réplication »[3],[4].
Virothérapie orientée contre le cancer[modifier | modifier le code]
Dans le domaine de la lutte contre le cancer et les tumeurs, un adénovirus peut être reprogrammé pour spécifiquement viser les cellules cancéreuses et les tissus cancéreux afin de les détruire. En principe, la virothérapie anticancéreuse pourrait devenir dans le futur une alternative appréciée des oncologues et des patients, face à la chirurgie, la radiothérapie et la chimiothérapie, mais elle n'est pas encore maîtrisée.
La recherche en matière de conception, production et utilisation de « virus tueurs de cancer » (le candidat serait l'« adénovirus oncolytique ») comme cheval de Troie (effecteur et/ou transporteur d'un gène thérapeutique) n'en est qu'à ses prémisses.
Des virus atténués de type vaccinaux pourraient permettre de tuer les cellules cancéreuses, d'une manière alternative aux thérapies conventionnelles[5]
Fonctionnement[modifier | modifier le code]
Tout d'abord est injecté un virus génétiquement modifié au patient souffrant de cancer. Il s'introduira ensuite uniquement dans les cellules cancéreuses et se multipliera produisant des protéines de deux types : stimulant l'immunité et d'autres détruisant la cellule cancéreuse. Cette cellule va ensuite éclater et libérer des antigènes renforçant l'immunité. Les virus survivants vont répéter l'opération avec d'autres cellules cancéreuses[6].
Pratique[modifier | modifier le code]
En 2020, une équipe américano-britannique a testé le processus sur 30 patients atteints d'un cancer de la peau, et avec l'immunothérapie combinée avec le virus RP1, une réduction de la tumeur de plus de 30% s'était produite chez 70% des patients, sans effets secondaires graves[6].
Avantage/inconvénient, limites[modifier | modifier le code]
Avantages[modifier | modifier le code]
Un virus bien programmé pour n'attaquer que les cellules cancéreuses est supposé pouvoir se reproduire jusqu'à ce qu'il ait tué toutes les cellules cancéreuses présentes. Les adénovirus (virus à ADN) ont été retenus dans de nombreux essais cliniques pour ce type d'opération car pouvant introduire leur « matériel génétique » dans la cellule cible sans attendre la mitose (division cellulaire) et sans insérer la nouvelle information génétique dans le génome de la cellule cible, cependant on ne sait pas encore complètement supprimer leur caractère potentiellement pathogène[7] ; ce vecteur, très utilisé dans les années 1990 est aujourd'hui moins envisagé en thérapie génique, car considéré comme pas assez sûr.
Inconvénients[modifier | modifier le code]
Produire par génie génétique des vecteurs viraux tout à fait sécurisé, notamment non susceptibles de muter pour produire une souche pathogène, est un processus long et complexe, seulement partiellement maîtrisé. En effet, deux essais cliniques utilisant les vecteurs rétroviraux murins pour modifier les cellules hématopoïétiques (traitement de l'immunodéficience liée à une mutation portée par la chaîne gamma-c du récepteur à l'interleukine-2 (voir plus bas), et traitement de la maladie de Gaucher) ont conduit à l'apparition de formes de leucémies chez les patients. Toutes les séquences virales codant des protéines permettant au virus d'être pathogène doivent être supprimées afin de ne maintenir que celles qui permettent la construction de la particule virale et assure le cycle infectieux. Les premiers essais ont été faits avec des rétrovirus de souris modifiés puis avec vecteurs dérivés du virus VIH, ex. : contre l'adrénoleucodystrophie par l'équipe Cartier-Aubourg à Paris testé à partir de 2007, ou contre le VIH aux États-Unis depuis 2000…
Il faut ensuite introduire dans le génome viral les séquences du gène thérapeutique de telle manière qu'elles puissent être transmises et s'exprimer au niveau de leur cible.
Le virus doit atteindre sa cible avant d'être détruit par le système immunitaire.
Limites[modifier | modifier le code]
L'adénovirus cible normalement un récepteur dit « CAR ». Or, l'absence ou la faible expression du récepteur primaire adénoviral « CAR » à la surface des cellules tumorales a déjà été associée à l'agressivité d'une tumeur. Cette faible expression du « CAR » est donc un facteur limitant l’efficacité de la virothérapie anti-tumorale[8],[9]. Les oncogénéticiens doivent donc trouver des moyens détournés de faire atteindre leur cible par les virus.
Contourner les limites[modifier | modifier le code]
Il faut donc développer des vecteurs viraux visant d'autres cibles que le récepteur « CAR » ou il faut permettre de renforcer d'une autre manière l'attractivité de la cellule tumorale pour le virus programmé pour la tuer, par exemple en ciblant des récepteurs intégrines de la famille αvβ connus pour être « surexprimés » par de nombreuses cellules cancéreuses[10],[11], ce qu'on a pu faire en modifiant génétiquement un adénovirus qui — in vitro comme in vivo — attaque plus efficacement des cellules gliales ou ovariennes cancéreuses[12],[13] ou de carcinomes rénaux[10].
Il est également possible d'atténuer l'immunité pour favoriser le virus génétiquement modifié, ce à quoi l'irradiation semble pouvoir contribuer[14], mais qui n'est pas sans risque pour la santé du patient.
Histoire et prospective[modifier | modifier le code]

La thérapie génique est évoqué dès la fin des années 1960[15] se concrétise par des essais prometteurs à la fin des années 1980 puis par de premiers succès (chez des enfants-bulles) dans les années 2000, avec toutefois des effets secondaires graves, mais continue à se développer[16]. Près de 2 000 essais cliniques auraient été proposés dans le monde en 2013[17], souvent contre le cancer.
Parmi les pistes de recherche en cours de développement figurent :
- l'utilisation d'une stratégie associant à la virothérapie de nouveaux médicaments anticancéreux, par exemple des inhibiteurs d’histone - désacétylases (HDACi[18], dont fait partie l’acide valproique qui pourrait peut être aider à combattre certains cancers du colon ; récemment breveté dans cette optique) ;
- des modifications de la capside virale (contre des carcinomes rénaux).
Notes et références[modifier | modifier le code]
- (en) Carter BJ, « Adeno-associated virus vectors in clinical trials » Hum. Gene Ther. 2005;16(5):541-50.
- (en) Didier Trono « Lentiviral vectors: turning a deadly foe into a therapeutic agent » Gene Ther. 2000;7(1):20-23.
- (en) Alba R, A. Bosch et al. (2005), « Gutless adenovirus: last - generation adenovirus for gene therapy » Gene Ther. 2005;12(Suppl 1):S18-27.
- (en) Vetrini F et P. Ng, « Gene therapy with helper - dependent adenoviral vectors: current advances and future perspectives » Viruses. 2010;2:1886-917.
- Jean-François Fonteneau vidéo pédagogique : En-quoi-consiste-la-virotherapie-anti-tumorale ? (INSERM)
- Kheira Bettayeb et Hugo Leroux, « Les 6 nouveaux traitements pour vaincre enfin le cancer », Science&Vie, no 1261, , p.76
- (en) Campos SK, Barry MA. « Current advances and future challenges in Adenoviral vector biology and targeting » Curr. Gene Ther. 2007;7(3):189-204.
- (en) Haviv YS, J. L. Blackwell et al. « Adenoviral gene therapy for renal cancer requires retargeting to alternative cellu lar receptors » Cancer Res. 2002;62:4273-81.
- (en) Li Y, R. C. Pong et al. « Loss of adenoviral receptor expression in human bladder cancer cells: a potential impact on the efficacy of gene therapy » Cancer Res. 1999;59:325-30.
- (en) Guse K, Ranki T et al. « Treatment of metastatic renal cancer with capsid - modified oncolytic adenoviruses » Mol Cancer Ther. 2007;6:2728-36.
- (en) Alonso, M. M., H. Jian g et al. « Delta - 24 - RGD in combination with RAD001 induces enhanced anti - glioma effect via autophagic cell death » Mol Ther. 2008;16:487-93.
- (en) Fueyo, J., R. Alemany et al. « Preclinical characterization of the antiglioma activity of a tropism - enhanced adenovirus targeted to the retinoblastoma pathway » J Natl Cancer Inst. 2003;95:652-60.
- (en) Lamfers, M. L., S. Idema et al. « Differential effects of combined Ad5 - delta 24RGD and radiation ther apy in in vitro versus in vivo models of malignant glioma » Clin. Cancer Res.. 2007;13:7451-8.
- (en) Zhang, M., S. Li et al. « Ionizing radiation increases adenovirus uptake and improves transgene expression in intrahepatic colon cancer xenografts ». Mol Ther. 2003;8:21-28.
- (en) Joshua Lederberg et Edward Tatum, Reflections on Research and the Future of Medicine, Columbia University, 1966.
- Heard JM, Danos O et Marc Peschanski, « Réflexions sur l'avenir de la thérapie génique », Médecine/sciences, 2000, vol.16, no 12, p. 1305-9.
- Journal of Gene Medicine, Wiley Intersciences
- voir chap III Les inhibiteurs d’histone-désacétylases in Christian Bressy, Potentialisation de la virothérapie anti-tumorale basée sur des adénovirus oncolytiques dans le traitement des cancers côliques et rénaux. Agricultural sciences. université Paris Sud - Paris XI, 2013.
Voir aussi[modifier | modifier le code]
Articles connexes[modifier | modifier le code]
Liens externes[modifier | modifier le code]
- Le site de Lysogene : thérapie génique intracérébrale
- (en) Gene Therapy: Molecular Bandage? Genetic Science Learning Center de l'université d'Utah
- (en) Gene Therapy Clinical Trials Worldwilde
Bibliographie[modifier | modifier le code]
- (en) Zhang, Z., W. Zou et al. « Suppression of tumor growth by oncolytic adenovirus - mediated delivery of an antiangiogenic gene, soluble Flt-1 » Mol Ther. 2005;11:553-62.
- (en) Zhong, S., D. Yu et al. « An armed oncolytic adenovirus ZD55 - IL - 24 combined with ADM or DDP demonstrated enhanced antitumor effect in lung cancer » Acta Oncol. 2010;49:91-9.
- (en) Zhu, M., J. A. Bristol et al. « Linked tumor-selective virus replication and transgene expression fromE3-containing oncolytic adenoviruses » J Virol. 2005;79:5455-65.
Vidéographie[modifier | modifier le code]
- (fr) Jean-François Fonteneau vidéo pédagogique : En-quoi-consiste-la-virotherapie-anti-tumorale ? (INSERM)

